2024年8月20日,浙江同源康医药股份有限公司成功在香港联交所主板上市,募集资金规模约5.79亿港元。阳光融汇资本于2020年参与同源康医药B轮融资。

浙江同源康医药股份有限公司(以下简称“公司)成立于2017年11月,是一家专注于小分子药物开发,致力于发现、开发创新靶向治疗并对其进行商业化的生物制药企业,旨在解决癌症治疗中未满足的临床需求。公司在浙江湖州长兴生命科学园建立了6,000平方米新药研发中心,随后在上海建立了公司行政总部、临床医学部和商务拓展部,在郑州设立了小分子药物筛选平台,在湖州长兴拥有建设中的新药制剂厂,是国内少数拥有药物研发和生产能力的创新型生物医药高科技公司。

公司拥有一批国际化视野的研发和管理团队,核心高管平均工作经验超过20年,包括4位国家特聘专家、7位省级特聘专家和十余位海归专家和博士。公司经过七年的蓬勃发展,员工人数已经达到140余人,拥有覆盖药物发现、成药性评价、CMC、临床、注册、商务拓展、运营等全流程团队。
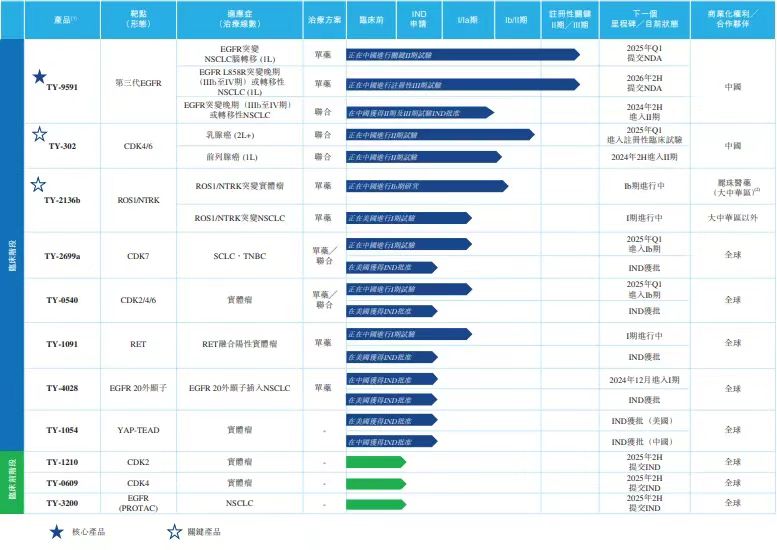
公司目前共有11条在研药物管线,包括核心产品TY-9591、6款临床阶段产品及4款临床前阶段或早期临床开发阶段产品。
来源:同源康医药招股书
核心管线第三代EGFR-TKI药物TY-9591是阿斯利康开发的重磅产品第三代EGFR-TKI奥希替尼(2023年全球销售58亿美元)的“me-better”药物,不仅保留了奥西替尼的优势,还显著减少引起奥希替尼不良反应的主要代谢物TY-9591-D1(AZ5104),有望具有更好的安全性,拓宽治疗窗口。针对TY-9591的临床策略,公司战略性地专注于EGFR突变非小细胞肺癌(NSCLC)脑转移(目前尚无核准药物的领域)以及EGFR 21外显子L858R突变的局部晚期或转移性NSCLC(一种亟需更有效治疗的适应症)。
根据弗若斯特沙利文的资料,晚期NSCLC患者脑转移的发生率在诊断时接近25%,约30%至55%的NSCLC患者在治疗期间发生脑转移。尽管中国和全球已有多个第三代EGFR-TKI获批上市,但尚无针对NSCLC脑转移的药物获批上市,临床需求亟待满足,公司TY-9591在NSCLC脑转移人群中显示出优异的抗肿瘤效果,有望在这一领域取得突破。TY-9591单药治疗晚期NSCLC的Ib期及 II期临床研究,入组29例初治可评估NSCLC脑转移患者中,观察到25例患者达到颅内部分缓解(“PR”)及4例患者达到完全缓解(“CR”),颅内客观缓解率(“ORR”)为100%。目前正在进行TY-9591单药一线治疗EGFR突变NSCLC脑转移的关键II期临床试验。公司预计于2024年内完成患者入组,2025年向国家药品监督管理局(NMPA)申请有条件上市。
EGFR 21外显子L858R突变是NSCLC中第二常见的突变,预计2027年中国的市场规模将达到79亿人民币。根据奥希替尼III期FLAURA 研究,在EGFR 19外显子缺失病例中观察到的无进展生存期(“PFS”)为21.4个月,而对于EGFR 21外显子L858R突变的NSCLC患者,其PFS则为14.4个月。因此,对于EGFR 21外显子L858R突变的NSCLC患者,存在亟待满足的临床需求。公司的Ib期研究临床数据显示,在EGFR 21外显子L858R突变的NSCLC患者中,PFS为19.3个月,对比III期FLAURA试验中的奥西替尼治疗,104例患者PFS为14.4个月,显著延长了PFS。因此,TY-9591在治疗21外显子L858R突变的NSCLC患者方面与奥西替尼相比,预计具有更好的疗效。目前正在进行TY-9591头对头对比奥希替尼,一线治疗EGFR L858R突变的局部晚期或转移性NSCLC的注册性III期临床试验,是目前全球唯一一个敢与奥希替尼进行头对头试验的第三代GFR-TKI药物。公司预计于2024年第四季度完成患者入组,2026年提交上市申请。
除TY-9591外,公司处于临床阶段的产品还包括CDK4/6抑制剂TY-302、 ROS1/NTRK抑制剂TY-2136b、CDK7抑制剂TY-2699a、选择性CDK2/4/6抑制剂TY-0540、TY-4028(EGFR-TKI)和RET抑制剂TY-1091。
今日公司港股上市,对于公司发展来说是一个重要的里程碑;更为重要的是公司核心产品的两个关键临床均已接近尾声,期望公司产品能够早日上市,造福患者。
关于阳光融汇资本
阳光融汇资本成立于2015年1月,是中国保险业首批由保险资金发起设立的私募基金管理公司。历经9年发展,阳光融汇资本基金管理规模达300亿元,业务板块涵盖母基金、直投业务,聚焦医疗、新兴科技、新消费、不动产领域。

- 原文地址
- http://www.riverheadcapital.cn/web/information_news_detail.php?id=169
- 复制链接
